L'évolution du modèle atomique

1808
Toute la matière est constituée de petites particules indivisibles appelées atomes. Selon ce modèle, l’atome était solide.
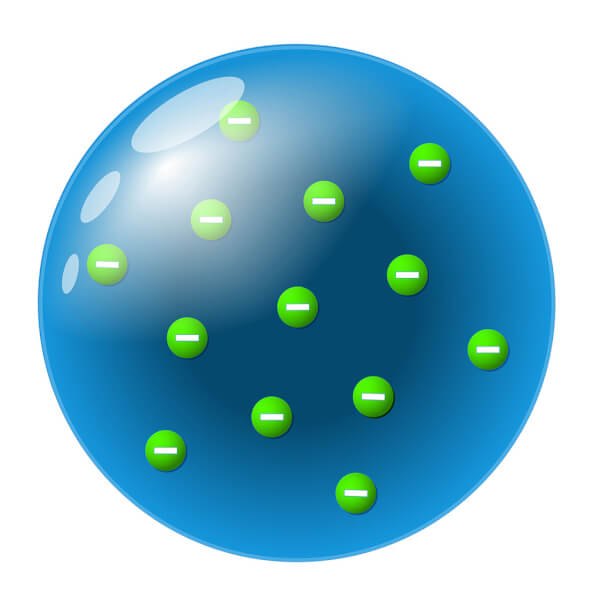
1904
L’électron est découvert par le scientifique Joseph Thomson, et le modèle évolue. Ce modèle est une boule de matière positive remplie de petits grains négatifs, les électrons. On l’appelle aussi le modèle du « pain aux raisins ».
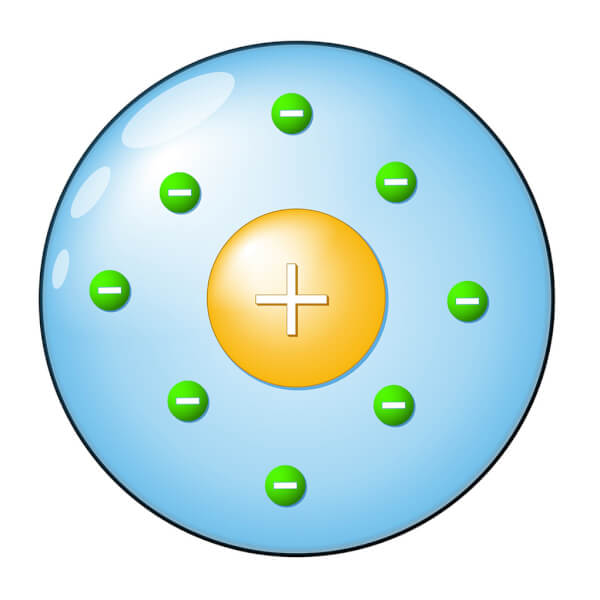
1911
Ernest Rutherford découvre que l’atome est en grande partie vide. Il découvre également la particule subatomique positive, le proton. Le modèle est maintenant un noyau très petit et dense formé de protons. Les électrons gravitent autour du noyau, comme les planètes autour du Soleil.
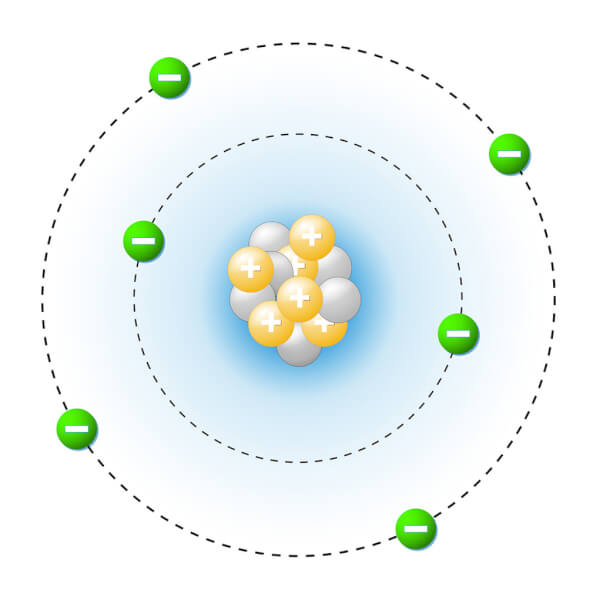
1913-1932
Niels Bohr, élève de Rutherford, poursuit ses recherches et détermine que les électrons circulent en orbite autour du noyau sur des couches électroniques. James Chadwick découvre ensuite le neutron, trouvé dans le noyau, ce qui complète ce modèle.

1926
Ce modèle explique que les électrons sont en fait situés dans des orbitales, c’est-à-dire des endroits probables autour du noyau. C’est le scientifique Erwin Schrodinger qui propose pour la première fois ce modèle qui évolue ensuite avec les années.